Поворознюк В. В. Быстрицкая М.А. ГУ "Институт геронтологии АМН Украины", Киев
Актуальность. Боль в нижней части спины уже в течение многих лет остается одной из наиболее частых причин обращения к врачам во всех странах мира (Поворознюк В.В., 2003). По данным разных источников от 60 до 80% больных – это лица работоспособного возраста от 30 до 59 лет [1, 3]. Среди причин возникновения болевого синдрома одну из важных позиций занимает повреждение межпозвонковых дисков. Выпячивание фиброзного кольца может приводить к дискрадикулярному конфликту с возникновением выраженного болевого синдрома, двигательных, чувствительных и рефлекторных нарушений. На сегодняшний день не существует конкретных рекомендаций относительно ведения больных с повреждением межпозвонковых дисков. Среди множества средств лечения этого состояния ни один не имеет достаточного количества проведенных исследований с длительными, статистически достоверными результатами.
Следовательно, в нынешней медицине параллельно существуют разные методы лечения заболеваний, обусловленных повреждениями межпозвонковых дисков, оперативные и консервативные, фармакологические и физиотерапевтические, но именно удачное сочетание отдельных методик является залогом успеха лечения. При наличии боли в спине, которая вызвана остеохондрозом позвоночника, традиционно применяют нестероидные противовоспалительные препараты, миорелаксанты, физиотерапевтические методики, но все эти средства не влияют на непосредственную причину возникновения боли – повреждение межпозвонкового диска. Диск состоит из пульпозного ядра, плотно окруженного фиброзным кольцом, образованным из фиброзной хрящевой ткани. Благодаря большому содержанию воды ядро не сжимается и обеспечивает амортизационные функции. К 10-летнему возрасту погибают почти все клетки пульпозного ядра и развиваются дегенеративные изменения . В тканях диска происходит деградация протеогликанового матрикса за счет активации металлопротеиназы, интерлейкина-1 и других факторов, снижается содержимое хондроитина сульфата-4, наступает дегидратация и частичная потеря функции пульпозного ядра. В результате уменьшения высоты диска увеличивается нагрузка на фиброзное кольцо и возникают предпосылки к его разволокнению. Во время резкого повышения давления в этом сегменте в фиброзном кольце образуются трещины, элементы пульпозного ядра смещаются, образовывая выпячивание (протрузии), а при разрыве фиброзного кольца – грыжу (пролапс) межпозвонкового диска (МПД) с возможным формированием относительной нестабильности позвоночника, остеофитоза тел позвонков (спондилоз), сжиманием спинномозгового корешка (радикулопатия), спинного мозга (миелопатия) или сосудов соответствующего бассейна). В результате повторного травмирования, а также возрастных инволютивных изменений прогрессирует деградация протеогликанов матрикса МПД за счет активации металлопротеиназы, интерлейкина-1 и других факторов, снижение содержимого хондроитина сульфата-4, дегидратация и частичная потеря функции пульпозного ядра.
Боль в спине, вызванная патологией МПД до сих пор является нерешенной проблемой. Двигательные расстройства, нарушения контроля функции тазовых органов и быстрый рост неврологического дефицита, требуют оперативного лечения, по крайней мере немедленной консультации нейрохирурга. Открытая микрохирургическая декомпрессия является золотым стандартом лечения поясничной грыжи межпозвоночных дисков сагитальным размером свыше 5 мм, которые вызывают компрессию спинномозгового корешка или стеноз позвоночного канала. По данным литературы эффективность такого вмешательства составляет 90%, осложнение менее чем 2%, однако при пролапсах меньшего размера эффективность значительно ниже.
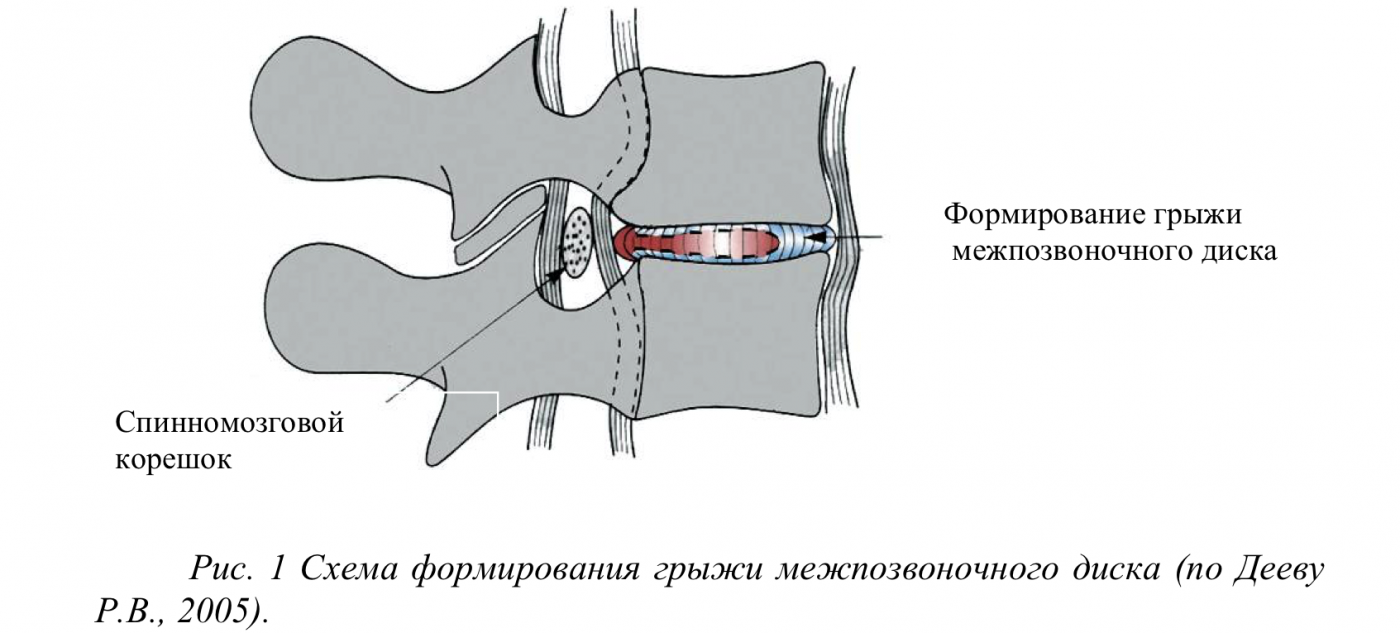
Но часто больные не спешат с операцией и отдают предпочтение консервативным методам. Одним из альтернативных вариантов является метод хемонуклеолизиса, то есть расщепления или деградации пульпозного ядра в результате химической реакции после чрезкожного введения непосредственно в ткани диска вещества для нуклеолиза дегенерированного диска. В большинстве случаев с этой целью используют папаин и химопапаин. Папаин – монотиоловая цистеиновая эндопротеаза, по характеру ферментативного действия называемая "растительным пепсином". Но в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах, а также в широком температурном диапазоне (до 50-
Формирование грыжи межпозвоночного диска. Спинномозговой корешок
60°C).
Преимущества метода – низкая травматичность и сохранение регенерационного потенциала пульпозного ядра.
Но при таком методе лечения часто возникают пирогенные и аллергические реакции. Впервые такая процедура была проведена в 50-х годах ХХ века и используется до сих пор. Согласно American Pain Society Clinical Practice Guideline (Рекомендаций Американской ассоциации боли) от 2009 года хемонуклеолизис занимает достойное место в перечне консервативных методов лечения боли в спине [8]. Ограничение в применении методики связано, во-первых, с серьезными осложнениями процедуры, а именно аллергическими реакциями вплоть до анафилактического шока, выраженным нейротоксичным действием протеолитических ферментов при попадании в субарахноидальное пространство при невнимательной инъекции, во-вторых, с необходимостью высокой квалификации медицинского персонала. Однако, с 1975 года хемонуклеолизис получили около 16000 пациентов, из них 70-90% с оценкой хорошо и отлично [6]. Папаин вызывает дегидратацию протеогликанов пульпозного ядра, тем самым снижая внутридисковое давление и механически уменьшая выпячивание элементов диска [7].
На территории бывшего СССР с 70-х годов также использовали полиферментные препараты (Папаин, Лекозим, Карипазим) для лечения дегенеративных заболеваний позвоночника. Были исследованы и применялись разные методики введения препаратов – внутридисковый, внутримышечный или подкожный с последующей гальванизацией или обработкой ультразвуком, чрезкожный электрофорез.
Теперь в нашей стране зарегистрирован лишь один протеолитический ферментный комплекс – Карипаин, (производитель НПК "АС-КОМ", Москва) в состав которого входят три фермента (папаин, химопапаин, протеиназа) и лизоцим. Карипаин – лекарственное средство растительного происхождения, полученное из латекса папайи. Папайя, также известная как mamão, pawpaw, дыннон дерево (Carica papaya).
Карипаин разрешен лишь для внешнего применения, потому в нашем исследовании было изучено влияние карипаина на вертебральный болевой синдром, введенный методом электрофореза.
Следовательно, целью нашего исследования было изучение эффективности и безопасности электрофореза с Карипаином в составе комплексного лечения вертебрального болевого синдрома, обусловленного дегенеративно-дистрофическими изменениями межпозвонковых дисков пояснично-крестцового отдела позвоночника.
Материал и методы. Исследование проводилось в отделе клинической физиологии и патологии опорно-двигательного аппарата ДУ "Институт геронтологии АМН Украины".
Критерии внесения пациентов в исследование:
– Возраст 30-65 лет.
– Мужчины и женщины.
– Остеохондроз поясничного отдела позвоночника и связанный с ним болевой синдром.
– Боль на момент первичного обследования свыше 4 см по ВАШ.
– Наличие компрессионно-корешкового синдрома в виде чувствительных или рефлекторных нарушений.
– Наличие протрузий межпозвонковых дисков в поясничном отделе позвоночника, размером от 3 до 6 мм по данным МРТ.
Критерии исключения:
– Компрессионно-корешковый синдром с двигательными нарушениями, дисфункцией тазовых органов, снижением чувствительности, в зоне промежности.
– Наличие признаков секвестрации межпозвонкового диска по данным МРТ.
– Повышенная чувствительность к любому компоненту препарата, который исследуется.
– Патология кожи в зоне проведения электрофореза.
– Патология сердечно-сосудистой системы или онкологические заболевания, которые есть противопоказаниями к проведению электрофореза.
В исследование было включено 15 пациентов в возрасте от 30 до 65 лет (средний возраст 47,1±4,2 лет). Среди них женщин 8 (53%), мужчин 7 (47%). У всех больных до обследования была проведена магнитно-резонансная томография (МРТ) поясничного отдела позвоночника, с помощью которой были диагностированы протрузии межпозвонковых дисков на уровне поясничного отдела позвоночника, размером от 3 до 6 мм. У 9 больных протрузии МПД на уровне L5-S1, у 6 больных протрузии на уровне L4-L5. Длительность болевого синдрома составляла не менее 2-х месяцев. У всех больных с момента проведения МРТ не было отмечено значительного ухудшения клинического состояния, которое могло бы свидетельствовать о прогрессе протрузии МПД или разрыв фиброзного кольца.
Все больные получали комплексное лечение, которое включало нестероидные противовоспалительные средства, миорелаксанты, лечебную физкультуру и электрофорез с Карипаином на поясничный участок позвоночника.
Методика проведения электрофореза
1 г сухого вещества разводили в 5-10 мл физраствора, добавляли 2-3
2 капли димексида и наносили на тканевую прокладку, размером 100 см .
Раствор вводили с анода. Электрофорез выполняли двухканальным аппаратом для электролечения в импульсном режиме (МИТ ЭФ 2). Электроды размещали паравертебрально перекрестно по продольной методике на расстоянии 10-15 см один от другого. Модулирующая частота составляла 37 Гц. Длительность первой процедуры 10 минут, с последующим увеличением на 3 минуты каждой следующей процедуры до 20 минут. На курс 10 процедур ежедневно, с возможным перерывом 1-2 дня.
Состояние больных оценивали дважды: перед лечением и после лечения – через 14 суток. Все пациенты были обследованы, согласно плану, приемлемому для ортопедического больного. Рядом с общеклиническими и рентгенологически исследованиями проводили определение интенсивности болевого синдрома по четырехсоставной визуально-аналоговой шкалой боли (ВАШ) и по Мак-Гиловским опроснику, использовали опросник Роланда- Морриса „Боль в нижней части спины и нарушения жизнедеятельности", опросник Оствестри и опросник Цунга. Кроме того, все пациенты заполняли Европейский опросник качества жизни – 5 направлений (EvroQol-5D).
Результаты исследования и их обсуждение. Показатели интенсивности болевого синдрома по опроснику Мак-Гила до лечения составили: дескрипторы – 11,3±1,6 баллов, ранги – 25,0±4,6 баллов, индекс боли, – 5,3±0,3, что свидетельствует об умеренной выраженности боли, длительность болевого синдрома не менее 2 месяцев. Уровень тревожности по шкале Цунга составил 14,0±2,6 баллов. Нарушение жизнедеятельности, связанное с вертебральным болевым синдромом, по опросникам Оствестри и Роланда-Морриса у обследованных больных составило 27,6±2,3 и 10,3±1,0 баллов соответственно.
После проведенного курса лечения у больных определено достоверное снижение интенсивности болевого синдрома по показателям ВАШ (рис. 2) и Мак-Гиловского опросника (рис. 3) и достоверное улучшение жизнедеятельности по опросникам Цунга, Роланда-Морриса, Оствестри (рис. 4) и EvroQol-5D (табл. 1).
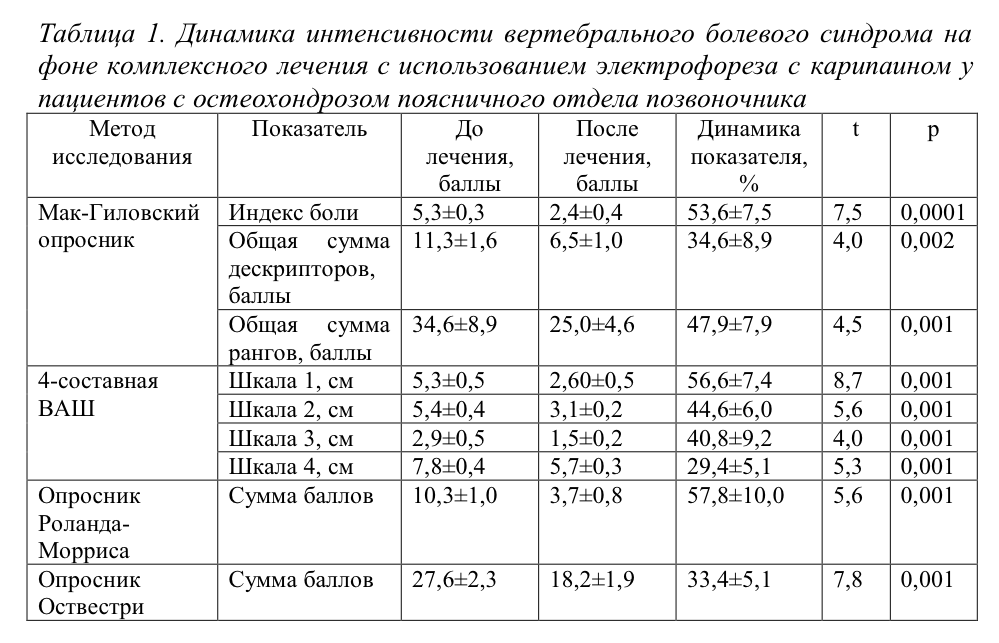
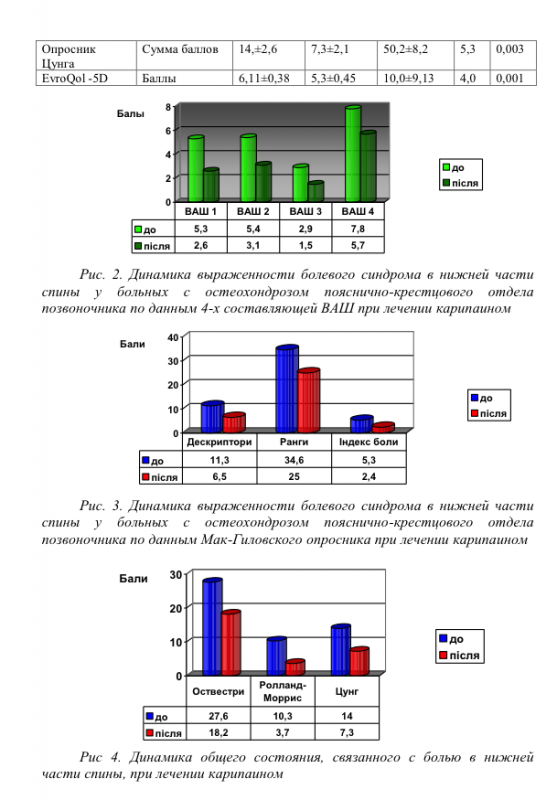
Дегенеративные процессы в пульпозном ядре, вызванные разнообразными факторами, сопровождаются воспалением и отеком тканей, приводят к повышению давления внутри диска и тем самым нарушают процессы диффузии, необходимые для поддержания нормального метаболизма тканей диска, а потому дегенеративные изменения прогрессируют. Следовательно, уменьшение внутридискового давления является патогенетическим методом лечения, и способствует не только редукции проявлений радикулопатии, но и уменьшению вертебрального болевого синдрома.
В исследовании, проведенном в ГУ "Институт неврологии, психиатрии и наркологии АМН Украины", получены позитивные результаты в 77,27% больных, по данным интенсивности болевого синдрома снижение боли составило около 34% по ВАШ [12]. Подобные данные получены и в нашем исследовании: снижение интенсивности болевого синдрома от 29,4±5,1% к 56,6±7,4% по разным подшкалам четырехсоставной ВАШ. Согласно отчету харьковских исследователей побочные эффекты возникали не часто – один случай (5%) генерализованой аллергической реакции, которая привела к прекращению лечения, 3 (13%) случая местной реакции в виде покраснения и высыпания, которые не нуждались в изменении схемы лечения. В нашем исследовании побочные реакции зарегистрированы не были, что, по нашему мнению, объясняется меньшим количеством исследуемых и более коротким курсом лечения. Представленные в работе результаты являются предварительными. По нашему мнению, применение Карипаина является перспективным направлением в консервативном лечении осложненного остеохондроза, что является основанием к продолжению и планированию новых исследований.
Выводы. Комплексное лечение больных с остеохондрозом пояснично- крестцового отдела позвоночника с протрузиями межпозвонковых дисков с применением электрофореза с карипаином обуславливает уменьшение интенсивности вертебрального болевого синдрома на 53,6±7,5% и повышает повседневную активность и уровень жизнедеятельности пациентов от 33,4±5,1 к 57,8±10,0% по данным разных опросников. Отмеченный способ лечения является безопасным для применения как в стационарных, так и в амбулаторных условиях.
Литература.
1. The Burden of Musculoskeletal conditions at the start of the New
Millennium Report of a WHO Scientific Group, Geneva (2003) http://www.emro.who.int/ncd/publications/musculoskeletalconditions.pdf.
2. Поворознюк В,В, Заболевание костно-мышечной системы у людей разного возраста (избранные лекции, обзоры, статьи): В 2-х томах. – К., 2004. – 520 с.
3. Борткевич О.П., Галицкая А.К., Бойчук Н.С. Синдром боли в спине и перспективы хондропротекторной терапии // Украинский ревматологический журнал. – 2006. – No 4 (26). – С.47-52.
4. Horwitz T. The human notochord: A study of its development and regression, variations, and pathologic derivative, chordoma. // Indianapolis, 1977.
5. Деев Р.В. Новые направления в реконструкции межпозвонковых дисков – клеточная трансплантация и тканевая инженерия / Клеточная трансплантология и тканевая инженерия. – 2005. – No 5. – С. 48-50.
6. Postacchini F., Cinotti G., Gumina S. Microsurgical excision of lateral lumbar disc herniation through an interlaminar approach // J Bone Joint Surg. – 1998. – 80-B. – Р. 201-7.
7. Köknel G.T., Derby R. Chemonucleolysis in low back pain // AGRI. – 2008. – 20(2). – Р.8-13.
8. Chou R., Atlas S.J., Rosenquist R.W. Nonsurgical interventional therapies for low back pain: a raview of the evidence for an American Pain Society Clinical Practice Guideline // Spine. – 2009. – 34 (10). – Р. 1078-93.
9. Wittenberg R.H., Oppel S., Rubenthaler F.A., Steffen R. Five-year results from chemonucleolysis with chymopapain or collagenase: a prospective randomized study // Spine. – 2001. – 26 (17). – Р. 1835-41.
10.Sumida K., Sato K., Aoki M. et al. Serial changes in the rate of proteoglycan synthesis after chemonucleolysis of rabbit intervertebral discs // Spine. – 1999. – 24(11). – Р. 1066-70.
11.Поворознюк В.В., Литвин В.О., Орлик Т.В. Боль в нижней части спины // Доктор – 2003. – No1 – С. 31 – 37.
12.Отчет о клиническом исследовании "Изучение эффективности препаратов серии "Карипаин" у больных вертеброневрологического профиля", 2009 http://www.karipain.com.ua.
13.Покотило Л.И. Методика применения препаратов "Карипаин" для физиотерапевтов / Поликлиника – 2007 – No3 – С.20-22.
Эффективность комплексного лечения вертебрального болевого синдрома с применением электрофореза с карипаином у больных с остеохондрозом пояснично-крестцового отдела позвоночника
Поворознюк В. В. Бистрицкая М.А.
ДУ "Институт геронтологии АМН Украины", Киев
Ключевые слова: боль, остеохондроз, карипаин
Резюме
В отделе клинической физиологии и патологии опорно-двигательного аппарата ГУ "Институт геронтологии АМН Украины" было проведено изучение эффективности и безопасности электрофореза с Карипаином в
составе комплексного лечения вертебрального болевого синдрома, обусловленного дегенеративно-дистрофическими изменениями межпозвонковых дисков пояснично-крестцового отдела позвоночника. После проведенного курса лечения у больных определенно достоверное снижение интенсивности болевого синдрома по показателям ВАШ и Мак-Гиловского опросника и достоверное улучшение жизнедеятельности по опросникам Цунга, Роланда-Морриса, Оствестри и EvroQol-5D.






